进口医疗器械海关如何监管
医疗器械,是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用。

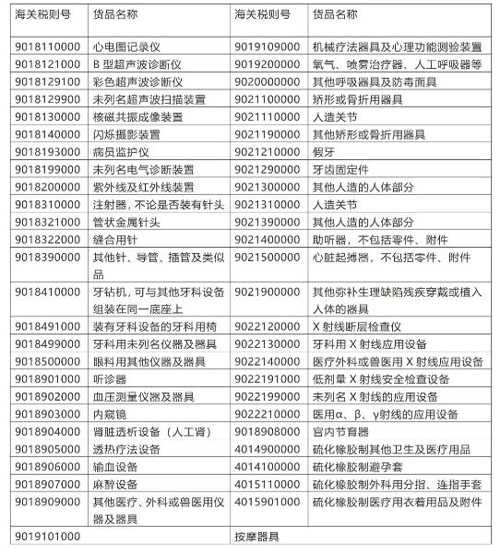
海关于2017年9月正式发布《医疗器械分类目录》,于2018年8月1日正式实施,共22个子目录,将260个产品类别细化调整为206个一级产品类别和1157个二级产品类别,形成三级目录层级结构。第一类医疗器械实行产品备案管理,第二类、第三类医疗器械实行产品注册管理。恒邦报关代理企业备案或注册,提交准许该医疗器械上市销售的证明文件。

进口的医疗器械应当是已注册或者已备案的医疗器械,医疗器械注册证有效期为5年。有效期届满需要延续注册的,应当在有效期届满6个月前向原注册部门提出延续注册的申请。海关对进口医疗器械备案/注册证(包括医疗器械注册证、第一类医疗器械备案凭证)电子数据与进口医疗器械产品报关单电子数据实施联网核查。
进口医疗器械报关时应提供合同、发票、装箱单、医疗器械备案/注册证。进口的医疗器械应当有中文说明书、中文标签。说明书、标签应当符合本条例规定以及相关强制性标准的要求,并在说明书中载明医疗器械的原产地以及境外医疗器械注册人、备案人指定的我国境内企业法人的名称、地址、联系方式。
海关依法对进口的医疗器械实施检验:核对现场查验的商品信息、申报信息、准入信息三者是否一致;核实进口医疗器械铭牌的有关信息是否与备案或注册的制造商、商品名称、型号规格一致。检验不合格的,不得进口。


